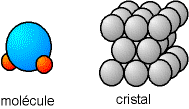
Fig. 3-1 Représentation d'une molécule d'eau (H2O) et d'un cristal avec le modèle des sphères dures
| précédent |
Le modèle le plus simple pour représenter un atome est un boule indéformable. Ainsi, un cristal atomique est un empilement régulier de ces boules, comme nous le représentons dans la page La matière cristalline. Une molécule peut se voir comme plusieurs boules accolées.

Fig. 3-1 Représentation d'une molécule d'eau (H2O)
et d'un cristal avec le modèle des sphères dures
On utilise parfois une représentation "éclatée" : les atomes sont représentés comme des petites boules espacées, reliées par des traits. Ceci permet de faire ressortir les directions privilégiées ainsi que les angles.
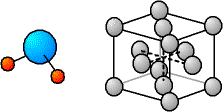
Fig. 3-2 Représentation éclatée
d'une molécule d'eau (H2O) et d'un cristal
avec le modèle éclaté des sphères dures
Ce modèle correspond bien à certaines propriétés de la matière, comme par exemple la difficulté de comprimer les liquides et les solides, ou bien le fait que les cristaux ont des faces bien lisses. Par contre, il ne permet pas d'expliquer d'autres propriétés, comme la forme des molécules : si les atomes n'ont pas de direction privilégiée, comment expliquer que les liaisons chimiques font un angle donné ?
| début |
Le second modèle utilisé sur ce site est le modèle développé par Niels Bohr en 1913 à partir des propriétés mises en évidence par Planck et Rutherford.
Dans le modèle des sphères dures, l'atome est un objet entier, indécomposable. Or, on sait depuis le milieu du XIXème siècle que l'on peut "arracher" des particules portant une charge électrique négative, les électrons.
Dans le modèle de Bohr, l'atome est composé d'un noyau chargé positivement, et d'électrons tournant autour, les orbites des électrons ne pouvant prendre que des valeurs définies.
Le noyau est très compact, d'un diamètre d'environs 10-15 à 10-14 m, c.-à-d. que le noyau est cent mille à un million de fois plus petit que l'atome ; il porte une charge électrique positive. C'est aussi la partie la plus lourde de l'atome, puisque le noyau représente au moins 99,95 % de la masse de l'atome.
Les électrons sont ponctuels, c'est à dire que leur taille est supposée quasiment nulle (tout du moins plus petite que ce que l'on peut estimer). Ils portent une charge négative. Pour des raisons de lisibilité, le dessin ci-dessous n'est pas à l'échelle.
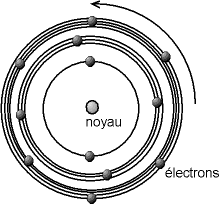
Fig. 3-3 Modèle de l'atome de Bohr
Cette vision permet de décrire très bien les phénomènes spectroscopiques, c.-à-d. le fait que les atomes absorbent ou émettent seulement certaines longueur d'onde (ou couleur) de lumière ou de rayons X. En effet, les électrons ne pouvant tourner que sur des orbites définies, le saut d'une orbite à une autre se fait en absorbant ou en émettant une quantité déterminée d'énergie.
Par rapport au modèle des sphères dures, la surface de la sphère correspond à l'orbite de l'électron le plus à l'extérieur. Ce modèle est plus précis, puisqu'il décompose l'atome en deux parties, un noyau et un nuage d'électrons.
Cependant, il présente un gros inconvénient : si les électrons tournaient, ils devraient rayonner de l'énergie comme toute charge accélérée. Donc, les électrons perdraient de l'énergie et viendraient s'écraser sur le noyau. Ce modèle n'explique pas non plus la forme des molécules.
| début |
Le modèle développé par Erwin Schrödinger en 1926, puis par Paul Dirac en 1928, permet d'expliquer la stabilité de l'atome. Dans ce modèle, les électrons ne sont plus des billes localisées et tournantes, mais des nuages. Cela peut choquer en première approche, mais n'oubliez pas le premier paragraphe de cette page : personne n'a jamais vu d'atome, donc encore moins d'électron. Tout ce que l'on connaît des électrons, ce sont leurs manifestations : courant électrique, tube cathodique (télévision)... Si l'on s'imagine l'électron comme une petite bille, c'est parce que c'est l'image que certaines personnes ont donnée pour vulgariser la notion.
Depuis les années 1930, on modélise l'électron par une «fonction d'onde» dont la «norme représente la densité de probabilité de présence». Pour représenter fidèlement les propriétés de l'électron, on n'a donc que des fonctions mathématiques à notre disposition. Ceci est très abstrait, et rebute même de nombreux physiciens. Nous allons essayer de donner un image de cette notion de fonction d'onde, image nécessairement imparfaite.
Imaginons qu'hors de l'atome, l'électron soit une petite bille. Lorsque l'électron est capturé par l'atome, il se "dissout" et devient un nuage diffus, il s'"évapore". Quand on l'arrache de l'atome, il redevient une petite bille, il se "recondense". Il existe d'autres exemples d'objet qui changent de forme, par exemple, hors de l'eau, le sel est sous forme de cristaux ; mis dans l'eau, il se dissout, et si l'on fait s'évaporer l'eau, on retrouve des cristaux. Le sel change de forme (cristal compact ou dissout dans l'eau), mais on a tout le temps du sel.

Fig. 3-4 Arrachement d'un électron du nuage électronique
Si l'on représente la densité dde ces nuages en fonction de la distance r au noyau, on trouve une courbe dont le maximum correspond au rayon r0 de l'orbite dans le modèle de Bohr.
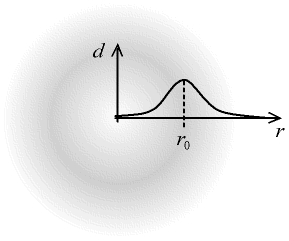
Fig. 3-5 Densité radiale du nuage électronique
- la densité est indiquée par des niveaux de gris,
la courbe densité d en fonction de la distance r au noyau
est tracée en superposition
Ces nuages peuvent prendre différentes formes, qui sont décrites par les «harmoniques sphériques». La forme la plus simple est la symétrie sphérique, c'est celle qui est montrée ci-dessus. Les autres formes ont des directions privilégiées, ceci permet d'expliquer la forme des molécules.
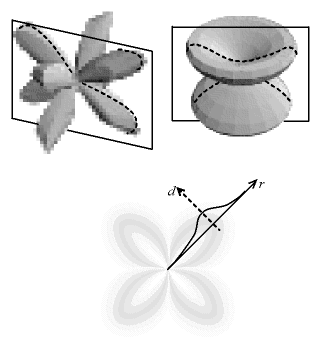
Fig. 3-6 Nuage électronique anisotrope
- en haut : deux exemples de forme,
avec un plan de coupe
- en bas : la densité est représentée
par des niveaux de gris,
pour un plan coupant les nuages ci-dessus (la coupe est similaire),
la courbe densité d
en fonction de la distance r au noyau
est indiquée pour une direction donnée
Pour simplifier la représentation, nous représenterons le nuage électronique par la surface d'isodensité maximale. La différence entre cette représentation et celle de Bohr est double :
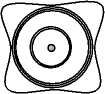
Fig. 3-7 Représentation de Schrödinger simplifiée
du nuage électronique
Ce modèle permet d'expliquer
| début |
En physique quantique, l'électron est représenté par une «fonction d'onde», notée traditionnellement |ψ>. C'est une fonction complexe de l'espace, c.-à-d. une fonction de R3 dans C qui à chaque position M(x,y,z) associe un nombre complexe a+i.b. Cette fonction représente la densité de probabilité de présence, c.-à-d. que si l'on définit un petit volume dV autour d'un point M, il y a une probabilité ||ψ>(M)|2.dV que l'électron s'y trouve.
En physique "classique", un objet est caractérisé par des paramètres tels que sa masse, sa charge électrique, la position de son centre de gravité, sa vitesse etc... L'évolution des paramètres de cet objet dans un champ de potentiel est donnée par des équations ; par exemple, dans le champ de pesanteur, la position et de la vitesse en fonction du temps sont données par le principe fondamental de la dynamique (loi de Newton).
En physique quantique, on utilise l'équation de Schrödinger
H|ψ> = E.|ψ>où H est l'opérateur hamiltonien (qui fait la dérivée seconde de la fonction d'onde), et E est l'énergie totale de l'objet. La résolution de cette équation donne les nuages représentés ci-dessus.